(→Zobacz też) |
|||
| (Nie pokazano 8 pośrednich wersji utworzonych przez tego samego użytkownika) | |||
| Linia 1: | Linia 1: | ||
== Receptory opioidowe == | == Receptory opioidowe == | ||
| − | Substancje uśmierzające ból były używane przez ludzkość od zamierzchłych czasów. Stosowanie opium, substancji otrzymywanej w procesie suszenia gęstego soku z niedojrzałych owoców maku lekarskiego (mak lekarski – łac. Papaver Somniferum), datuje się już na 3400 rok p.n.e. [1]. Początkowo wyciąg z maku lekarskiego był stosowany jako element kultu religijnego ze względu na silne działanie na układ nerwowy. Przyjmowanie mikstury wywoływało uczucie euforii, prowadziło do stanu otępienia i odurzenia. Pierwsze przekazy opisujące stosowanie opium na terenie Europy w celach medycznych (przeciwbólowych, uspokajających czy nasennych) pochodzą z roku 1500 n.e. W roku 1806 po raz pierwszy z opium wyodrębniono jeden z czynnych składników – morfinę, nazwaną tak na cześć boga snu Morfeusza. Od końca dziewiętnastego wieku morfinę zaczęto stosować w medycynie do celów terapeutycznych. | + | Substancje uśmierzające ból były używane przez ludzkość od zamierzchłych czasów. Stosowanie opium, substancji otrzymywanej w procesie suszenia gęstego soku z niedojrzałych owoców maku lekarskiego (mak lekarski – ''łac. Papaver Somniferum''), datuje się już na 3400 rok p.n.e. [1]. Początkowo wyciąg z maku lekarskiego był stosowany jako element kultu religijnego ze względu na silne działanie na układ nerwowy. Przyjmowanie mikstury wywoływało uczucie euforii, prowadziło do stanu otępienia i odurzenia. Pierwsze przekazy opisujące stosowanie opium na terenie Europy w celach medycznych (przeciwbólowych, uspokajających czy nasennych) pochodzą z roku 1500 n.e. W roku 1806 po raz pierwszy z opium wyodrębniono jeden z czynnych składników – morfinę, nazwaną tak na cześć boga snu Morfeusza. Od końca dziewiętnastego wieku morfinę zaczęto stosować w medycynie do celów terapeutycznych. |
Wyciąg z maku lekarskiego zawiera liczne substancje psychoaktywne. W skład opium wchodzi mieszanina ponad 40 alkaloidów, które możemy podzielić na dwie podstawowe grupy: pochodne fenantrenu (morfina, kodeina, tebaina) oraz pochodne izochinoliny (papaweryna, emetyna). Pierwsza grupa związków, zwana opiatami, wywiera istotny wpływ na układ nerwowy człowieka. W roku 1973 wykazano, iż niektóre substancje zawarte w wyciągu z opium oddziaływają na specyficzne receptory zlokalizowane w centralnym układzie nerwowym [2-4], nazwane później receptorami opioidowymi. W latach 1977-90 potwierdzono występowanie trzech typów receptorów opioidowych: MOR, DOR oraz KOR, wykazujących selektywność w wiązaniu ligandów [5, 6]. Ostatecznie w 1992 roku zidentyfikowano oraz poddano ekspresji geny kodujące wszystkie trzy typy receptorów opioidowych [7-13], co w znacznym stopniu przyczyniło się do szybkiego rozwoju badań nad tymi białkami. | Wyciąg z maku lekarskiego zawiera liczne substancje psychoaktywne. W skład opium wchodzi mieszanina ponad 40 alkaloidów, które możemy podzielić na dwie podstawowe grupy: pochodne fenantrenu (morfina, kodeina, tebaina) oraz pochodne izochinoliny (papaweryna, emetyna). Pierwsza grupa związków, zwana opiatami, wywiera istotny wpływ na układ nerwowy człowieka. W roku 1973 wykazano, iż niektóre substancje zawarte w wyciągu z opium oddziaływają na specyficzne receptory zlokalizowane w centralnym układzie nerwowym [2-4], nazwane później receptorami opioidowymi. W latach 1977-90 potwierdzono występowanie trzech typów receptorów opioidowych: MOR, DOR oraz KOR, wykazujących selektywność w wiązaniu ligandów [5, 6]. Ostatecznie w 1992 roku zidentyfikowano oraz poddano ekspresji geny kodujące wszystkie trzy typy receptorów opioidowych [7-13], co w znacznym stopniu przyczyniło się do szybkiego rozwoju badań nad tymi białkami. | ||
| Linia 6: | Linia 6: | ||
Receptory opioidowe występują głównie w centralnym układzie nerwowym, w błonie komórkowej neuronów. Możemy je również odnaleźć w niektórych typach mięśni gładkich. Ich obecność stwierdzono także m.in. w przewodzie pokarmowym, komórkach układu immunologicznego, w macicy, sercu oraz płucach. Skutki oddziaływania substancji opioidowych (zdolnych do modulacji aktywności podstawowej receptorów opioidowych) na organizm człowieka są liczne i bardzo zróżnicowane. Zaliczamy do nich: osłabienie reakcji na bodźce pochodzące z otoczenia, takie jak dotyk, dźwięk czy światło; otępienie, stany euforyczne jak i depresyjne. Substancje te wywierają wpływ na ciśnienie tętnicze, częstość skurczów mięśnia sercowego, regulują także funkcje oddechowe. Receptory opioidowe odgrywają także kluczową rolę w kaskadach sygnalizacyjnych odpowiedzialnych za odczuwanie bólu, regulacje funkcji motorycznych, psychofizycznych jak i kontrolę nastroju [14]. | Receptory opioidowe występują głównie w centralnym układzie nerwowym, w błonie komórkowej neuronów. Możemy je również odnaleźć w niektórych typach mięśni gładkich. Ich obecność stwierdzono także m.in. w przewodzie pokarmowym, komórkach układu immunologicznego, w macicy, sercu oraz płucach. Skutki oddziaływania substancji opioidowych (zdolnych do modulacji aktywności podstawowej receptorów opioidowych) na organizm człowieka są liczne i bardzo zróżnicowane. Zaliczamy do nich: osłabienie reakcji na bodźce pochodzące z otoczenia, takie jak dotyk, dźwięk czy światło; otępienie, stany euforyczne jak i depresyjne. Substancje te wywierają wpływ na ciśnienie tętnicze, częstość skurczów mięśnia sercowego, regulują także funkcje oddechowe. Receptory opioidowe odgrywają także kluczową rolę w kaskadach sygnalizacyjnych odpowiedzialnych za odczuwanie bólu, regulacje funkcji motorycznych, psychofizycznych jak i kontrolę nastroju [14]. | ||
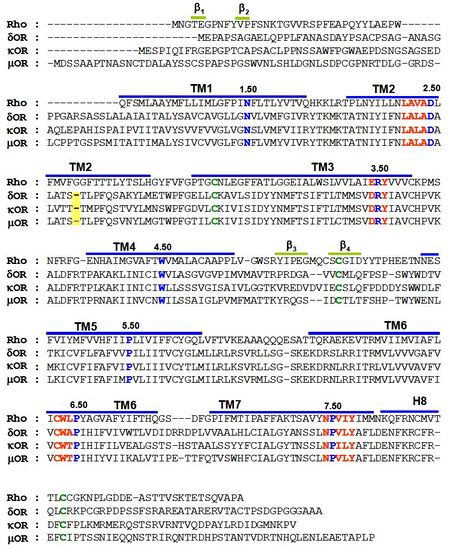
| − | [[Image:align.jpg|thumb|upright|450px| Rys. 1. Uliniowienie sekwencji trzech receptorów opioidowych DOR, KOR i MOR oraz sekwencji rodopsyny. Kolorem niebieskim zaznaczono najlepiej zachowane w ewolucji reszty obecne w helisach I-VII, kolorem czerwonym motywy charakterystyczne dla rodziny A receptorów GPCR, kolorem zielonym zaznaczono: dwie cysteiny tworzące wiązanie disulfidowe (pomiędzy helisą TMH:III oraz drugą pętlą zewnątrzkomórkową) oraz palmitylowaną cysteinę z helisy VIII. Linie niebieskie wyznaczają położenie | + | [[Image:align.jpg|thumb|upright|450px| Rys. 1. Uliniowienie sekwencji trzech receptorów opioidowych DOR, KOR i MOR oraz sekwencji rodopsyny. Kolorem niebieskim zaznaczono najlepiej zachowane w ewolucji reszty obecne w helisach I-VII, kolorem czerwonym motywy charakterystyczne dla rodziny A receptorów GPCR, kolorem zielonym zaznaczono: dwie cysteiny tworzące wiązanie disulfidowe (pomiędzy helisą TMH:III oraz drugą pętlą zewnątrzkomórkową) oraz palmitylowaną cysteinę z helisy VIII. Linie niebieskie wyznaczają położenie α-helis transbłonowych w uliniowionych sekwencjach receptorów. Linie zielone oznaczają lokalizacje b-kartek w sekwencji rodopsyny. Kolorem żółtym oznaczono przerwę w sekwencji receptorów opioidowych w helisie II. Uliniowienie sekwencji wykonane na podstawie pracy [43].]] |
| − | Receptory opioidowe, w odpowiedzi na związanie zewnątrzkomórkowej cząsteczki sygnałowej, aktywują białka | + | Receptory opioidowe, w odpowiedzi na związanie zewnątrzkomórkowej cząsteczki sygnałowej, aktywują białka G<sub>i</sub> oraz G<sub>o</sub> po wewnętrznej stronie błony komórkowej. Następnie, podjednostka Ga-GTP oraz podkompleks Gbg docierają do miejsc docelowych, białek efektorowych, którymi są między innymi kanały jonowe (wapniowe i potasowe) oraz enzymy błonowe (np. cyklaza adenylowa). Jednorazowe działanie agonistów receptorów opioidowych skutkuje zahamowaniem aktywności cyklazy adenylowej co prowadzi do obniżenia poziomu cAMP, pełniącego rolę przekaźnika drugiego rodzaju (''ang. second messenger''). Przy długotrwałym działaniu agonistów obserwujemy natomiast kompensacyjną up-regulację tego enzymu i wzrost poziomu cAMP, co może być przyczyną zwiększonej pobudliwości neuronów. Obecność cAMP wywiera także wpływ na proces regulacji genów, przez fosforylację czynników transkrypcyjnych, które z kolei wiążą się z elementami regulatorowymi odpowiednich genów. Wiadomo, iż receptory opioidowe pełnią ważną funkcję w procesie uwalniania przekaźników neuronalnych, kontrolując stan bramkowanych napięciem kanałów wapniowych, zlokalizowanych w błonie presynaptycznych zakończeń nerwowych. Również, poprzez regulację przepustowości kanałów potasowych [15] receptory te mogą spowalniać przekazywanie impulsów nerwowych poprzez neurony [16-18]. Długotrwałe stosowanie substancji opioidowych może prowadzić do uzależnienia [19]. Receptory opioidowe wywierają wpływ na wydzielanie dopaminy - neuroprzekaźnika syntezowanego i uwalnianego przez neurony ośrodkowego układu nerwowego [20]. Układ dopaminowy stoi u podstawy zjawiska wzmocnienia pozytywnego, które jest związane z działaniem leków uzależniających. Długotrwale przyjmowanie opioidów prowadzi do nasilenia wydzielania dopaminy odpowiedzialnej za intensywność w układzie nagrody oraz stan określany w uproszczeniu jako euforia, a także za zjawiska motywacyjne. |
Ze względu na swoje właściwości farmakologiczne, receptory opioidowe stały się przedmiotem licznych badań niezwykle istotnych dla przemysłu farmaceutycznego. Znalezienie substancji wykazujących wysoką selektywność oraz powinowactwo względem jednego z trzech podtypów receptorów opioidowych: MOR, DOR i KOR, pomogłoby w zaprojektowaniu skutecznych leków przeciwbólowych, antydepresyjnych, leków stosowanych w leczeniu uzależnień, powodujących mniej efektów ubocznych. Niestety nadal stan wiedzy dotyczący struktur tych białek receptorowych oraz mechanizmów ich aktywacji jak i dezaktywacji jest bardzo ograniczony. | Ze względu na swoje właściwości farmakologiczne, receptory opioidowe stały się przedmiotem licznych badań niezwykle istotnych dla przemysłu farmaceutycznego. Znalezienie substancji wykazujących wysoką selektywność oraz powinowactwo względem jednego z trzech podtypów receptorów opioidowych: MOR, DOR i KOR, pomogłoby w zaprojektowaniu skutecznych leków przeciwbólowych, antydepresyjnych, leków stosowanych w leczeniu uzależnień, powodujących mniej efektów ubocznych. Niestety nadal stan wiedzy dotyczący struktur tych białek receptorowych oraz mechanizmów ich aktywacji jak i dezaktywacji jest bardzo ograniczony. | ||
| − | Obecny stan wiedzy potwierdza występowanie trzech głównych typów receptorów opioidowych: MOR, KOR i DOR [21] oraz receptora nocyceptyny, podobnego do receptorów opioidowych (ORL 1 – ang. opioid receptor like-1) [22-24]. Badania farmakologiczne sugerują również występowanie większej liczby podtypów tych receptorów (np. dwa receptory DOR i po trzy KOR i MOR) [25]. Może to wynikać z faktu, iż receptory te występują w formie homo- jak i hetero-dimerów oraz merów wyższych rzędów [26, 27], które także mogą być funkcjonalne. Wiadomo również, iż niektóre opioidy o właściwościach agonistycznych wykazują selektywność względem ściśle określonego dimeru lub monomeru [28] tych receptorów. | + | Obecny stan wiedzy potwierdza występowanie trzech głównych typów receptorów opioidowych: MOR, KOR i DOR [21] oraz receptora nocyceptyny, podobnego do receptorów opioidowych (ORL 1 – ''ang. opioid receptor like-1'') [22-24]. Badania farmakologiczne sugerują również występowanie większej liczby podtypów tych receptorów (np. dwa receptory DOR i po trzy KOR i MOR) [25]. Może to wynikać z faktu, iż receptory te występują w formie homo- jak i hetero-dimerów oraz merów wyższych rzędów [26, 27], które także mogą być funkcjonalne. Wiadomo również, iż niektóre opioidy o właściwościach agonistycznych wykazują selektywność względem ściśle określonego dimeru lub monomeru [28] tych receptorów. |
| − | Receptory opioidowe należą do rodziny A receptorów GPCR (zwanej także rodziną podobnych do rodopsyny; ang. rhodopsin like). Łańcuchy peptydowe receptorów opioidowych składają się odpowiednio z 372 AA - DOR, 380 AA - KOR oraz 398 AA - MOR. Pomimo braku struktury krystalicznej tych białek przyjmuje się, że są one zbudowane z siedmiu | + | Receptory opioidowe należą do rodziny A receptorów GPCR (zwanej także rodziną podobnych do rodopsyny; ''ang. rhodopsin like''). Łańcuchy peptydowe receptorów opioidowych składają się odpowiednio z 372 AA - DOR, 380 AA - KOR oraz 398 AA - MOR. Pomimo braku struktury krystalicznej tych białek przyjmuje się, że są one zbudowane z siedmiu α-helis przechodzących przez dwuwarstwę lipidową, połączonych ze sobą krótkimi pętlami. Helisa ósma jest położona prostopadle do błony po stronie wewnątrzkomórkowej. Podobieństwo sekwencyjne trzech receptorów opioidowych jest wysokie, procent identycznych aminokwasów dla poszczególnych par równy jest odpowiednio: 57% dla MOR i KOR, 61% dla DOR i KOR oraz 62% dla DOR i MOR [29]. Natomiast ponad 93% aminokwasów jest ewolucyjnie zachowanych dla danego typu receptora obecnego u przedstawicieli różnych gatunków. |
Uliniowienie sekwencji trzech receptorów opioidowych oraz sekwencji rodopsyny (Rys. 1.) pokazuje, iż w sekwencji receptorów opioidowych występują dobrze zachowane motywy, charakterystyczne dla innych przedstawicieli rodziny A, receptorów GPCR. Na helisie II obecny jest motyw LxxxD, na helisie III motyw E(D)RY, motyw CWxPxF(H) występuje na helisie VI, oraz motyw NPxxY na helisie VII (gdzie x – oznacza dowolny aminokwas). W każdym z receptorów opioidowych obecne jest wiązanie disulfidowe pomiędzy cysteiną z helisy III oraz cysteiną zlokalizowaną w drugiej pętli zewnątrzkomórkowej. Jest to cecha wspólna dla wszystkich GPCR-ów z rodziny A. Największe podobieństwo sekwencyjne występuje na odcinku transmembranowym, natomiast znikome podobieństwo widoczne jest w rejonie pętli zewnątrzkomórkowych oraz C- i N-końca. | Uliniowienie sekwencji trzech receptorów opioidowych oraz sekwencji rodopsyny (Rys. 1.) pokazuje, iż w sekwencji receptorów opioidowych występują dobrze zachowane motywy, charakterystyczne dla innych przedstawicieli rodziny A, receptorów GPCR. Na helisie II obecny jest motyw LxxxD, na helisie III motyw E(D)RY, motyw CWxPxF(H) występuje na helisie VI, oraz motyw NPxxY na helisie VII (gdzie x – oznacza dowolny aminokwas). W każdym z receptorów opioidowych obecne jest wiązanie disulfidowe pomiędzy cysteiną z helisy III oraz cysteiną zlokalizowaną w drugiej pętli zewnątrzkomórkowej. Jest to cecha wspólna dla wszystkich GPCR-ów z rodziny A. Największe podobieństwo sekwencyjne występuje na odcinku transmembranowym, natomiast znikome podobieństwo widoczne jest w rejonie pętli zewnątrzkomórkowych oraz C- i N-końca. | ||
| − | Dane eksperymentalne opisujące wpływ pojedynczych mutacji kierunkowych (ang. point mutations), oraz badania z zastosowaniem receptorów o zmienionej części łańcucha peptydowego (ang. receptor chimeras), pozwoliły na określenie prawdopodobnego miejsca wiązania typowych ligandów receptorów opioidowych [29-31]. Miejsce wiązania zlokalizowane jest we wnęce pomiędzy helisami od TMH:II do TMH:VII, którą przykrywają trzy pętle zewnątrzkomórkowe. Aminokwasy odpowiedzialne za wiązanie ligandów są w większości dobrze zachowane w trzech typach receptorów opioidowych: Asp:3.32, Tyr:3.33, Lys:5.39, Phe:5.47, Trp:6.48, Ile:6.51, His:6.52, Ile:6.53, Ile:7.39, and Tyr:7.43 [32-41] (numeracja według konwencji Ballesterosa-Weinsteina [42], gdzie pierwsza liczba oznacza numer helisy transbłonowej, druga to pozycja reszty liczona względem najbardziej zachowanego w ewolucji aminokwasu na tej helisie, oznaczonego numerem 50). | + | Dane eksperymentalne opisujące wpływ pojedynczych mutacji kierunkowych (''ang. point mutations''), oraz badania z zastosowaniem receptorów o zmienionej części łańcucha peptydowego (''ang. receptor chimeras''), pozwoliły na określenie prawdopodobnego miejsca wiązania typowych ligandów receptorów opioidowych [29-31]. Miejsce wiązania zlokalizowane jest we wnęce pomiędzy helisami od TMH:II do TMH:VII, którą przykrywają trzy pętle zewnątrzkomórkowe. Aminokwasy odpowiedzialne za wiązanie ligandów są w większości dobrze zachowane w trzech typach receptorów opioidowych: Asp:3.32, Tyr:3.33, Lys:5.39, Phe:5.47, Trp:6.48, Ile:6.51, His:6.52, Ile:6.53, Ile:7.39, and Tyr:7.43 [32-41] (numeracja według konwencji Ballesterosa-Weinsteina [42], gdzie pierwsza liczba oznacza numer helisy transbłonowej, druga to pozycja reszty liczona względem najbardziej zachowanego w ewolucji aminokwasu na tej helisie, oznaczonego numerem 50). |
| − | Badania dotyczące wiązania jonów | + | Badania dotyczące wiązania jonów Zn<sup>2+</sup> do zmodyfikowanej struktury receptorów opioidowych (''ang. engineered zinc-binding sites'') [43] sugerują, iż w przeciwieństwie do struktury rodopsyny, w miejscu znajdowania się reszty Gly w TMH:II na pozycji 2.56 nie występuje odpowiadający jej aminokwas w sekwencji trzech receptorów opioidowych. Brak reszty na wyżej wymienionej pozycji sprawia, iż ten fragment białka prawdopodobnie przyjmuje strukturę regularnej α-helisy (przerwa zaznaczona kolorem żółtym, (Rys. 1.)). |
| + | |||
| + | == Zobacz też == | ||
| + | * [[GPCR]] | ||
| + | * [[GPCR – struktury krystaliczne]] | ||
| + | * [[Białko G ]] | ||
| + | * [[Receptory ]] | ||
| + | * [[Receptory błonowe ]] | ||
| + | * [[Receptory serotoninowe ]] | ||
| + | * [[Rodopsyna]] | ||
== Literatura == | == Literatura == | ||
| + | # Brownstein, M.J., A brief history of opiates, opioid peptides, and opioid receptors. Proc Natl Acad Sci U S A, 1993. 90(12): p. 5391-3. | ||
| + | # Pert, C.B. and S.H. Snyder, Opiate receptor: demonstration in nervous tissue. Science, 1973. 179(77): p. 1011-4. | ||
| + | # Simon, E.J., J.M. Hiller, and I. Edelman, Stereospecific binding of the potent narcotic analgesic (3H) Etorphine to rat-brain homogenate. Proc Natl Acad Sci U S A, 1973. 70(7): p. 1947-9. | ||
| + | # Terenius, L., Stereospecific interaction between narcotic analgesics and a synaptic plasm a membrane fraction of rat cerebral cortex. Acta Pharmacol Toxicol (Copenh), 1973. 32(3): p. 317-20. | ||
| + | # Lord, J.A., et al., Endogenous opioid peptides: multiple agonists and receptors. Nature, 1977. 267(5611): p. 495-9. | ||
| + | # Kosterlitz, H.W., S.J. Paterson, and L.E. Robson, Characterization of the kappa-subtype of the opiate receptor in the guinea-pig brain. Br J Pharmacol, 1981. 73(4): p. 939-49. | ||
| + | # Yasuda, K., et al., Cloning and functional comparison of kappa and delta opioid receptors from mouse brain. Proc Natl Acad Sci U S A, 1993. 90(14): p. 6736-40. | ||
| + | # Raynor, K., et al., Characterization of the cloned human mu opioid receptor. J Pharmacol Exp Ther, 1995. 272(1): p. 423-8. | ||
| + | # Raynor, K., et al., Pharmacological characterization of the cloned kappa-, delta-, and mu-opioid receptors. Mol Pharmacol, 1994. 45(2): p. 330-4. | ||
| + | # Lai, J., et al., Pharmacological characterization of the cloned kappa opioid receptor as a kappa 1b subtype. Neuroreport, 1994. 5(16): p. 2161-4. | ||
| + | # Ammer, H. and R. Schulz, Stable expression and functional characterization of the cloned rat mu-opioid receptor in human epidermoid carcinoma (A431) cells. Zentralbl Veterinarmed A, 1996. 43(4): p. 193-200. | ||
| + | # Evans, C.J., et al., Cloning of a delta opioid receptor by functional expression. Science, 1992. 258(5090): p. 1952-5. | ||
| + | # Kieffer, B.L., et al., The delta-opioid receptor: isolation of a cDNA by expression cloning and pharmacological characterization. Proc Natl Acad Sci U S A, 1992. 89(24): p. 12048-52. | ||
| + | # Przewlocki, R. and B. Przewlocka, Opioids in chronic pain. Eur J Pharmacol, 2001. 429(1-3): p. 79-91. | ||
| + | # Chen, X., et al., Altered gating of opiate receptor-modulated K+ channels on amygdala neurons of morphine-dependent rats. Proc Natl Acad Sci U S A, 2000. 97(26): p. 14692-6. | ||
| + | # Mihara, S. and R.A. North, Opioids increase potassium conductance in submucous neurones of guinea-pig caecum by activating delta-receptors. Br J Pharmacol, 1986. 88(2): p. 315-22. | ||
| + | # Muller, W., S. Hallermann, and D. Swandulla, Opioidergic modulation of voltage-activated K+ currents in magnocellular neurons of the supraoptic nucleus in rat. J Neurophysiol, 1999. 81(4): p. 1617-25. | ||
| + | # Margolis, E.B., et al., Kappa-opioid agonists directly inhibit midbrain dopaminergic neurons. J Neurosci, 2003. 23(31): p. 9981-6. | ||
| + | # Raith, K. and G. Hochhaus, Drugs used in the treatment of opioid tolerance and physical dependence: a review. Int J Clin Pharmacol Ther, 2004. 42(4): p. 191-203. | ||
| + | # Zhang, Y., et al., Effect of the endogenous kappa opioid agonist dynorphin A(1-17) on cocaine-evoked increases in striatal dopamine levels and cocaine-induced place preference in C57BL/6J mice. Psychopharmacology (Berl), 2004. 172(4): p. 422-9. | ||
| + | # Dhawan, B.N., et al., International Union of Pharmacology. XII. Classification of opioid receptors. Pharmacol Rev, 1996. 48(4): p. 567-92. | ||
| + | # Meunier, J.C., et al., Isolation and structure of the endogenous agonist of opioid receptor-like ORL1 receptor. Nature, 1995. 377(6549): p. 532-5. | ||
| + | # Henderson, G. and A.T. McKnight, The orphan opioid receptor and its endogenous ligand--nociceptin/orphanin FQ. Trends Pharmacol Sci, 1997. 18(8): p. 293-300. | ||
| + | # Reinscheid, R.K., et al., Orphanin FQ: a neuropeptide that activates an opioidlike G protein-coupled receptor. Science, 1995. 270(5237): p. 792-4. | ||
| + | # Corbett, A.D., et al., 75 years of opioid research: the exciting but vain quest for the Holy Grail. Br J Pharmacol, 2006. 147 Suppl 1: p. S153-62. | ||
| + | # Gupta, A., F.M. Decaillot, and L.A. Devi, Targeting opioid receptor heterodimers: Strategies for screening and drug development. AAPS Journal, 2006. 8(1): p. E153-E159. | ||
| + | # Jordan, B.A. and L.A. Devi, G-protein-coupled receptor heterodimerization modulates receptor function. Nature, 1999. 399(6737): p. 697-700. | ||
| + | # Lunzer, M.M. and P.S. Portoghese, Selectivity of delta- and kappa-opioid ligands depends on the route of central administration in mice. J Pharmacol Exp Ther, 2007. 322(1): p. 166-71. | ||
| + | # Chaturvedi, K., et al., Structure and regulation of opioid receptors. Biopolymers, 2000. 55(4): p. 334-46. | ||
| + | # Law, P.Y. and H.H. Loh, Regulation of opioid receptor activities. J Pharmacol Exp Ther, 1999. 289(2): p. 607-24. | ||
| + | # Chavkin, C., J.P. McLaughlin, and J.P. Celver, Regulation of opioid receptor function by chronic agonist exposure: constitutive activity and desensitization. Mol Pharmacol, 2001. 60(1): p. 20-5. | ||
| + | # Li, J.G., et al., ASP147 in the third transmembrane helix of the rat mu opioid receptor forms ion-pairing with morphine and naltrexone. Life Sci, 1999. 65(2): p. 175-85. | ||
| + | # Befort, K., et al., Constitutive activation of the delta opioid receptor by mutations in transmembrane domains III and VII. J Biol Chem, 1999. 274(26): p. 18574-81. | ||
| + | # Meng, F., et al., Creating a functional opioid alkaloid binding site in the orphanin FQ receptor through site-directed mutagenesis. Mol Pharmacol, 1998. 53(4): p. 772-7. | ||
| + | # Bot, G., et al., Mutagenesis of a single amino acid in the rat mu-opioid receptor discriminates ligand binding. J Neurochem, 1998. 70(1): p. 358-65. | ||
| + | # Bot, G., et al., Mutagenesis of the mouse delta opioid receptor converts (-)-buprenorphine from a partial agonist to an antagonist. J Pharmacol Exp Ther, 1998. 284(1): p. 283-90. | ||
| + | # Spivak, C.E., et al., Naloxone activation of mu-opioid receptors mutated at a histidine residue lining the opioid binding cavity. Mol Pharmacol, 1997. 52(6): p. 983-92. | ||
| + | # Mansour, A., et al., Key residues defining the mu-opioid receptor binding pocket: a site-directed mutagenesis study. J Neurochem, 1997. 68(1): p. 344-53. | ||
| + | # Befort, K., et al., Role of aromatic transmembrane residues of the delta-opioid receptor in ligand recognition. J Biol Chem, 1996. 271(17): p. 10161-8. | ||
| + | # Befort, K., et al., The conserved aspartate residue in the third putative transmembrane domain of the delta-opioid receptor is not the anionic counterpart for cationic opiate binding but is a constituent of the receptor binding site. Mol Pharmacol, 1996. 49(2): p. 216-23. | ||
| + | # Surratt, C.K., et al., -mu opiate receptor. Charged transmembrane domain amino acids are critical for agonist recognition and intrinsic activity. J Biol Chem, 1994. 269(32): p. 20548-53. | ||
| + | # Ballesteros JA and W. H, Integrated methods for the construction of three-dimensional models and computational probing of structure-function relations in G protein-coupled receptors. Methods Neurosci, 1995. 25: p. 366-428. | ||
| + | # Fowler, C.B., et al., Refinement of a homology model of the mu-opioid receptor using distance constraints from intrinsic and engineered zinc-binding sites. Biochemistry, 2004. 43(27): p. 8700-10. | ||
Aktualna wersja na dzień 02:14, 27 sty 2012
Receptory opioidowe
Substancje uśmierzające ból były używane przez ludzkość od zamierzchłych czasów. Stosowanie opium, substancji otrzymywanej w procesie suszenia gęstego soku z niedojrzałych owoców maku lekarskiego (mak lekarski – łac. Papaver Somniferum), datuje się już na 3400 rok p.n.e. [1]. Początkowo wyciąg z maku lekarskiego był stosowany jako element kultu religijnego ze względu na silne działanie na układ nerwowy. Przyjmowanie mikstury wywoływało uczucie euforii, prowadziło do stanu otępienia i odurzenia. Pierwsze przekazy opisujące stosowanie opium na terenie Europy w celach medycznych (przeciwbólowych, uspokajających czy nasennych) pochodzą z roku 1500 n.e. W roku 1806 po raz pierwszy z opium wyodrębniono jeden z czynnych składników – morfinę, nazwaną tak na cześć boga snu Morfeusza. Od końca dziewiętnastego wieku morfinę zaczęto stosować w medycynie do celów terapeutycznych.
Wyciąg z maku lekarskiego zawiera liczne substancje psychoaktywne. W skład opium wchodzi mieszanina ponad 40 alkaloidów, które możemy podzielić na dwie podstawowe grupy: pochodne fenantrenu (morfina, kodeina, tebaina) oraz pochodne izochinoliny (papaweryna, emetyna). Pierwsza grupa związków, zwana opiatami, wywiera istotny wpływ na układ nerwowy człowieka. W roku 1973 wykazano, iż niektóre substancje zawarte w wyciągu z opium oddziaływają na specyficzne receptory zlokalizowane w centralnym układzie nerwowym [2-4], nazwane później receptorami opioidowymi. W latach 1977-90 potwierdzono występowanie trzech typów receptorów opioidowych: MOR, DOR oraz KOR, wykazujących selektywność w wiązaniu ligandów [5, 6]. Ostatecznie w 1992 roku zidentyfikowano oraz poddano ekspresji geny kodujące wszystkie trzy typy receptorów opioidowych [7-13], co w znacznym stopniu przyczyniło się do szybkiego rozwoju badań nad tymi białkami.
Receptory opioidowe występują głównie w centralnym układzie nerwowym, w błonie komórkowej neuronów. Możemy je również odnaleźć w niektórych typach mięśni gładkich. Ich obecność stwierdzono także m.in. w przewodzie pokarmowym, komórkach układu immunologicznego, w macicy, sercu oraz płucach. Skutki oddziaływania substancji opioidowych (zdolnych do modulacji aktywności podstawowej receptorów opioidowych) na organizm człowieka są liczne i bardzo zróżnicowane. Zaliczamy do nich: osłabienie reakcji na bodźce pochodzące z otoczenia, takie jak dotyk, dźwięk czy światło; otępienie, stany euforyczne jak i depresyjne. Substancje te wywierają wpływ na ciśnienie tętnicze, częstość skurczów mięśnia sercowego, regulują także funkcje oddechowe. Receptory opioidowe odgrywają także kluczową rolę w kaskadach sygnalizacyjnych odpowiedzialnych za odczuwanie bólu, regulacje funkcji motorycznych, psychofizycznych jak i kontrolę nastroju [14].
Receptory opioidowe, w odpowiedzi na związanie zewnątrzkomórkowej cząsteczki sygnałowej, aktywują białka Gi oraz Go po wewnętrznej stronie błony komórkowej. Następnie, podjednostka Ga-GTP oraz podkompleks Gbg docierają do miejsc docelowych, białek efektorowych, którymi są między innymi kanały jonowe (wapniowe i potasowe) oraz enzymy błonowe (np. cyklaza adenylowa). Jednorazowe działanie agonistów receptorów opioidowych skutkuje zahamowaniem aktywności cyklazy adenylowej co prowadzi do obniżenia poziomu cAMP, pełniącego rolę przekaźnika drugiego rodzaju (ang. second messenger). Przy długotrwałym działaniu agonistów obserwujemy natomiast kompensacyjną up-regulację tego enzymu i wzrost poziomu cAMP, co może być przyczyną zwiększonej pobudliwości neuronów. Obecność cAMP wywiera także wpływ na proces regulacji genów, przez fosforylację czynników transkrypcyjnych, które z kolei wiążą się z elementami regulatorowymi odpowiednich genów. Wiadomo, iż receptory opioidowe pełnią ważną funkcję w procesie uwalniania przekaźników neuronalnych, kontrolując stan bramkowanych napięciem kanałów wapniowych, zlokalizowanych w błonie presynaptycznych zakończeń nerwowych. Również, poprzez regulację przepustowości kanałów potasowych [15] receptory te mogą spowalniać przekazywanie impulsów nerwowych poprzez neurony [16-18]. Długotrwałe stosowanie substancji opioidowych może prowadzić do uzależnienia [19]. Receptory opioidowe wywierają wpływ na wydzielanie dopaminy - neuroprzekaźnika syntezowanego i uwalnianego przez neurony ośrodkowego układu nerwowego [20]. Układ dopaminowy stoi u podstawy zjawiska wzmocnienia pozytywnego, które jest związane z działaniem leków uzależniających. Długotrwale przyjmowanie opioidów prowadzi do nasilenia wydzielania dopaminy odpowiedzialnej za intensywność w układzie nagrody oraz stan określany w uproszczeniu jako euforia, a także za zjawiska motywacyjne.
Ze względu na swoje właściwości farmakologiczne, receptory opioidowe stały się przedmiotem licznych badań niezwykle istotnych dla przemysłu farmaceutycznego. Znalezienie substancji wykazujących wysoką selektywność oraz powinowactwo względem jednego z trzech podtypów receptorów opioidowych: MOR, DOR i KOR, pomogłoby w zaprojektowaniu skutecznych leków przeciwbólowych, antydepresyjnych, leków stosowanych w leczeniu uzależnień, powodujących mniej efektów ubocznych. Niestety nadal stan wiedzy dotyczący struktur tych białek receptorowych oraz mechanizmów ich aktywacji jak i dezaktywacji jest bardzo ograniczony.
Obecny stan wiedzy potwierdza występowanie trzech głównych typów receptorów opioidowych: MOR, KOR i DOR [21] oraz receptora nocyceptyny, podobnego do receptorów opioidowych (ORL 1 – ang. opioid receptor like-1) [22-24]. Badania farmakologiczne sugerują również występowanie większej liczby podtypów tych receptorów (np. dwa receptory DOR i po trzy KOR i MOR) [25]. Może to wynikać z faktu, iż receptory te występują w formie homo- jak i hetero-dimerów oraz merów wyższych rzędów [26, 27], które także mogą być funkcjonalne. Wiadomo również, iż niektóre opioidy o właściwościach agonistycznych wykazują selektywność względem ściśle określonego dimeru lub monomeru [28] tych receptorów.
Receptory opioidowe należą do rodziny A receptorów GPCR (zwanej także rodziną podobnych do rodopsyny; ang. rhodopsin like). Łańcuchy peptydowe receptorów opioidowych składają się odpowiednio z 372 AA - DOR, 380 AA - KOR oraz 398 AA - MOR. Pomimo braku struktury krystalicznej tych białek przyjmuje się, że są one zbudowane z siedmiu α-helis przechodzących przez dwuwarstwę lipidową, połączonych ze sobą krótkimi pętlami. Helisa ósma jest położona prostopadle do błony po stronie wewnątrzkomórkowej. Podobieństwo sekwencyjne trzech receptorów opioidowych jest wysokie, procent identycznych aminokwasów dla poszczególnych par równy jest odpowiednio: 57% dla MOR i KOR, 61% dla DOR i KOR oraz 62% dla DOR i MOR [29]. Natomiast ponad 93% aminokwasów jest ewolucyjnie zachowanych dla danego typu receptora obecnego u przedstawicieli różnych gatunków.
Uliniowienie sekwencji trzech receptorów opioidowych oraz sekwencji rodopsyny (Rys. 1.) pokazuje, iż w sekwencji receptorów opioidowych występują dobrze zachowane motywy, charakterystyczne dla innych przedstawicieli rodziny A, receptorów GPCR. Na helisie II obecny jest motyw LxxxD, na helisie III motyw E(D)RY, motyw CWxPxF(H) występuje na helisie VI, oraz motyw NPxxY na helisie VII (gdzie x – oznacza dowolny aminokwas). W każdym z receptorów opioidowych obecne jest wiązanie disulfidowe pomiędzy cysteiną z helisy III oraz cysteiną zlokalizowaną w drugiej pętli zewnątrzkomórkowej. Jest to cecha wspólna dla wszystkich GPCR-ów z rodziny A. Największe podobieństwo sekwencyjne występuje na odcinku transmembranowym, natomiast znikome podobieństwo widoczne jest w rejonie pętli zewnątrzkomórkowych oraz C- i N-końca.
Dane eksperymentalne opisujące wpływ pojedynczych mutacji kierunkowych (ang. point mutations), oraz badania z zastosowaniem receptorów o zmienionej części łańcucha peptydowego (ang. receptor chimeras), pozwoliły na określenie prawdopodobnego miejsca wiązania typowych ligandów receptorów opioidowych [29-31]. Miejsce wiązania zlokalizowane jest we wnęce pomiędzy helisami od TMH:II do TMH:VII, którą przykrywają trzy pętle zewnątrzkomórkowe. Aminokwasy odpowiedzialne za wiązanie ligandów są w większości dobrze zachowane w trzech typach receptorów opioidowych: Asp:3.32, Tyr:3.33, Lys:5.39, Phe:5.47, Trp:6.48, Ile:6.51, His:6.52, Ile:6.53, Ile:7.39, and Tyr:7.43 [32-41] (numeracja według konwencji Ballesterosa-Weinsteina [42], gdzie pierwsza liczba oznacza numer helisy transbłonowej, druga to pozycja reszty liczona względem najbardziej zachowanego w ewolucji aminokwasu na tej helisie, oznaczonego numerem 50).
Badania dotyczące wiązania jonów Zn2+ do zmodyfikowanej struktury receptorów opioidowych (ang. engineered zinc-binding sites) [43] sugerują, iż w przeciwieństwie do struktury rodopsyny, w miejscu znajdowania się reszty Gly w TMH:II na pozycji 2.56 nie występuje odpowiadający jej aminokwas w sekwencji trzech receptorów opioidowych. Brak reszty na wyżej wymienionej pozycji sprawia, iż ten fragment białka prawdopodobnie przyjmuje strukturę regularnej α-helisy (przerwa zaznaczona kolorem żółtym, (Rys. 1.)).
Zobacz też
- GPCR
- GPCR – struktury krystaliczne
- Białko G
- Receptory
- Receptory błonowe
- Receptory serotoninowe
- Rodopsyna
Literatura
- Brownstein, M.J., A brief history of opiates, opioid peptides, and opioid receptors. Proc Natl Acad Sci U S A, 1993. 90(12): p. 5391-3.
- Pert, C.B. and S.H. Snyder, Opiate receptor: demonstration in nervous tissue. Science, 1973. 179(77): p. 1011-4.
- Simon, E.J., J.M. Hiller, and I. Edelman, Stereospecific binding of the potent narcotic analgesic (3H) Etorphine to rat-brain homogenate. Proc Natl Acad Sci U S A, 1973. 70(7): p. 1947-9.
- Terenius, L., Stereospecific interaction between narcotic analgesics and a synaptic plasm a membrane fraction of rat cerebral cortex. Acta Pharmacol Toxicol (Copenh), 1973. 32(3): p. 317-20.
- Lord, J.A., et al., Endogenous opioid peptides: multiple agonists and receptors. Nature, 1977. 267(5611): p. 495-9.
- Kosterlitz, H.W., S.J. Paterson, and L.E. Robson, Characterization of the kappa-subtype of the opiate receptor in the guinea-pig brain. Br J Pharmacol, 1981. 73(4): p. 939-49.
- Yasuda, K., et al., Cloning and functional comparison of kappa and delta opioid receptors from mouse brain. Proc Natl Acad Sci U S A, 1993. 90(14): p. 6736-40.
- Raynor, K., et al., Characterization of the cloned human mu opioid receptor. J Pharmacol Exp Ther, 1995. 272(1): p. 423-8.
- Raynor, K., et al., Pharmacological characterization of the cloned kappa-, delta-, and mu-opioid receptors. Mol Pharmacol, 1994. 45(2): p. 330-4.
- Lai, J., et al., Pharmacological characterization of the cloned kappa opioid receptor as a kappa 1b subtype. Neuroreport, 1994. 5(16): p. 2161-4.
- Ammer, H. and R. Schulz, Stable expression and functional characterization of the cloned rat mu-opioid receptor in human epidermoid carcinoma (A431) cells. Zentralbl Veterinarmed A, 1996. 43(4): p. 193-200.
- Evans, C.J., et al., Cloning of a delta opioid receptor by functional expression. Science, 1992. 258(5090): p. 1952-5.
- Kieffer, B.L., et al., The delta-opioid receptor: isolation of a cDNA by expression cloning and pharmacological characterization. Proc Natl Acad Sci U S A, 1992. 89(24): p. 12048-52.
- Przewlocki, R. and B. Przewlocka, Opioids in chronic pain. Eur J Pharmacol, 2001. 429(1-3): p. 79-91.
- Chen, X., et al., Altered gating of opiate receptor-modulated K+ channels on amygdala neurons of morphine-dependent rats. Proc Natl Acad Sci U S A, 2000. 97(26): p. 14692-6.
- Mihara, S. and R.A. North, Opioids increase potassium conductance in submucous neurones of guinea-pig caecum by activating delta-receptors. Br J Pharmacol, 1986. 88(2): p. 315-22.
- Muller, W., S. Hallermann, and D. Swandulla, Opioidergic modulation of voltage-activated K+ currents in magnocellular neurons of the supraoptic nucleus in rat. J Neurophysiol, 1999. 81(4): p. 1617-25.
- Margolis, E.B., et al., Kappa-opioid agonists directly inhibit midbrain dopaminergic neurons. J Neurosci, 2003. 23(31): p. 9981-6.
- Raith, K. and G. Hochhaus, Drugs used in the treatment of opioid tolerance and physical dependence: a review. Int J Clin Pharmacol Ther, 2004. 42(4): p. 191-203.
- Zhang, Y., et al., Effect of the endogenous kappa opioid agonist dynorphin A(1-17) on cocaine-evoked increases in striatal dopamine levels and cocaine-induced place preference in C57BL/6J mice. Psychopharmacology (Berl), 2004. 172(4): p. 422-9.
- Dhawan, B.N., et al., International Union of Pharmacology. XII. Classification of opioid receptors. Pharmacol Rev, 1996. 48(4): p. 567-92.
- Meunier, J.C., et al., Isolation and structure of the endogenous agonist of opioid receptor-like ORL1 receptor. Nature, 1995. 377(6549): p. 532-5.
- Henderson, G. and A.T. McKnight, The orphan opioid receptor and its endogenous ligand--nociceptin/orphanin FQ. Trends Pharmacol Sci, 1997. 18(8): p. 293-300.
- Reinscheid, R.K., et al., Orphanin FQ: a neuropeptide that activates an opioidlike G protein-coupled receptor. Science, 1995. 270(5237): p. 792-4.
- Corbett, A.D., et al., 75 years of opioid research: the exciting but vain quest for the Holy Grail. Br J Pharmacol, 2006. 147 Suppl 1: p. S153-62.
- Gupta, A., F.M. Decaillot, and L.A. Devi, Targeting opioid receptor heterodimers: Strategies for screening and drug development. AAPS Journal, 2006. 8(1): p. E153-E159.
- Jordan, B.A. and L.A. Devi, G-protein-coupled receptor heterodimerization modulates receptor function. Nature, 1999. 399(6737): p. 697-700.
- Lunzer, M.M. and P.S. Portoghese, Selectivity of delta- and kappa-opioid ligands depends on the route of central administration in mice. J Pharmacol Exp Ther, 2007. 322(1): p. 166-71.
- Chaturvedi, K., et al., Structure and regulation of opioid receptors. Biopolymers, 2000. 55(4): p. 334-46.
- Law, P.Y. and H.H. Loh, Regulation of opioid receptor activities. J Pharmacol Exp Ther, 1999. 289(2): p. 607-24.
- Chavkin, C., J.P. McLaughlin, and J.P. Celver, Regulation of opioid receptor function by chronic agonist exposure: constitutive activity and desensitization. Mol Pharmacol, 2001. 60(1): p. 20-5.
- Li, J.G., et al., ASP147 in the third transmembrane helix of the rat mu opioid receptor forms ion-pairing with morphine and naltrexone. Life Sci, 1999. 65(2): p. 175-85.
- Befort, K., et al., Constitutive activation of the delta opioid receptor by mutations in transmembrane domains III and VII. J Biol Chem, 1999. 274(26): p. 18574-81.
- Meng, F., et al., Creating a functional opioid alkaloid binding site in the orphanin FQ receptor through site-directed mutagenesis. Mol Pharmacol, 1998. 53(4): p. 772-7.
- Bot, G., et al., Mutagenesis of a single amino acid in the rat mu-opioid receptor discriminates ligand binding. J Neurochem, 1998. 70(1): p. 358-65.
- Bot, G., et al., Mutagenesis of the mouse delta opioid receptor converts (-)-buprenorphine from a partial agonist to an antagonist. J Pharmacol Exp Ther, 1998. 284(1): p. 283-90.
- Spivak, C.E., et al., Naloxone activation of mu-opioid receptors mutated at a histidine residue lining the opioid binding cavity. Mol Pharmacol, 1997. 52(6): p. 983-92.
- Mansour, A., et al., Key residues defining the mu-opioid receptor binding pocket: a site-directed mutagenesis study. J Neurochem, 1997. 68(1): p. 344-53.
- Befort, K., et al., Role of aromatic transmembrane residues of the delta-opioid receptor in ligand recognition. J Biol Chem, 1996. 271(17): p. 10161-8.
- Befort, K., et al., The conserved aspartate residue in the third putative transmembrane domain of the delta-opioid receptor is not the anionic counterpart for cationic opiate binding but is a constituent of the receptor binding site. Mol Pharmacol, 1996. 49(2): p. 216-23.
- Surratt, C.K., et al., -mu opiate receptor. Charged transmembrane domain amino acids are critical for agonist recognition and intrinsic activity. J Biol Chem, 1994. 269(32): p. 20548-53.
- Ballesteros JA and W. H, Integrated methods for the construction of three-dimensional models and computational probing of structure-function relations in G protein-coupled receptors. Methods Neurosci, 1995. 25: p. 366-428.
- Fowler, C.B., et al., Refinement of a homology model of the mu-opioid receptor using distance constraints from intrinsic and engineered zinc-binding sites. Biochemistry, 2004. 43(27): p. 8700-10.